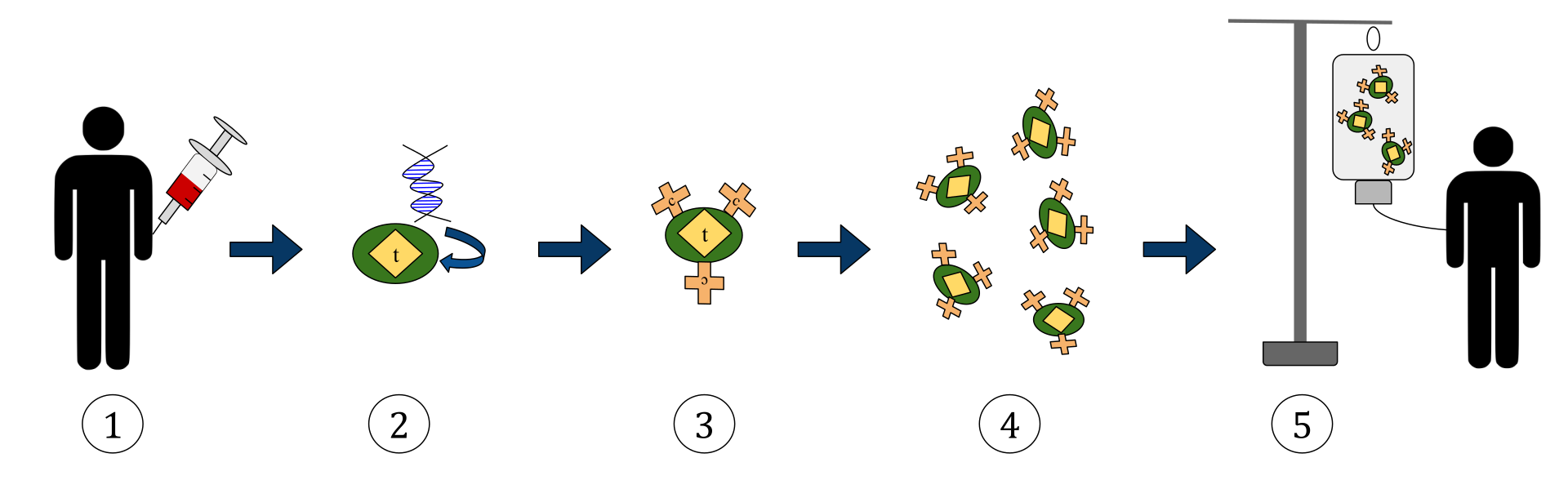
يمثل الرسم البياني أعلاه عملية العلاج بالخلايا التائية لمستقبل المستضد الوهمي (CAR). هذه طريقة من العلاج المناعي ، وهي ممارسة متنامية في علاج السرطان. يجب أن تكون النتيجة النهائية إنتاج الخلايا التائية المجهزة التي يمكنها التعرف على الخلايا السرطانية المصابة ومكافحتها في الجسم.
1. يتم إزالة الخلايا التائية (ممثلة بأشياء تحمل علامة “t”) من دم المريض.
2. ثم في المختبر ، يتم دمج الجين الذي يشفر لمستقبلات المستضدات المحددة في الخلايا التائية.
3. وبالتالي إنتاج مستقبلات CAR (المسمى c) على سطح الخلايا.
4. يتم بعد ذلك حصاد الخلايا التائية المعدلة حديثًا وتنميتها في المختبر.
5. بعد فترة زمنية معينة ، يتم ضخ الخلايا التائية المهندسة مرة أخرى في المريض.
مستقبلات المستضد الكيميري الخلايا التائية (المعروف أيضًا باسم خلايا CAR T) هي الخلايا التائية المهندسة وراثيًا لإنتاج مستقبلات الخلايا التائية الاصطناعية لاستخدامها في العلاج المناعي.
مستقبلات المستضد الكيميرية (سيارات، المعروف أيضًا باسم مستقبلات المناعة الخيمريةو مستقبلات الخلايا التائية الوهمية، أو مستقبلات الخلايا التائية الاصطناعية) هي بروتينات مُستقبِلة تمت هندستها لمنح الخلايا التائية القدرة الجديدة على استهداف بروتين معين. المستقبلات خيمرية لأنها تجمع بين كل من ربط مولد الضد ووظائف تنشيط الخلايا التائية في مستقبل واحد.
يستخدم العلاج بالخلايا التائية CAR-T الخلايا التائية المصممة باستخدام CARs لعلاج السرطان. تتمثل فرضية العلاج المناعي CAR-T في تعديل الخلايا التائية للتعرف على الخلايا السرطانية من أجل استهدافها وتدميرها بشكل أكثر فعالية. يحصد العلماء الخلايا التائية من البشر ، ثم يغيرونها وراثيًا ، ثم ينقلون الخلايا التائية الناتجة عن ذلك إلى المرضى لمهاجمة أورامهم. يمكن اشتقاق خلايا CAR-T إما من الخلايا التائية في دم المريض (ذاتيًا) أو مشتقة من الخلايا التائية لمتبرع سليم آخر (خيفي). بمجرد عزل هذه الخلايا التائية عن الشخص ، يتم تصميمها وراثيًا للتعبير عن CAR معين ، والذي يبرمجها لاستهداف مستضد موجود على سطح الأورام. من أجل السلامة ، تم تصميم خلايا CAR-T لتكون خاصة بمستضد يتم التعبير عنه في ورم لا يتم التعبير عنه في الخلايا السليمة.
بعد حقن خلايا CAR-T في المريض ، تعمل بمثابة “دواء حي” ضد الخلايا السرطانية. عندما تتلامس مع مستضدها المستهدف في الخلية ، ترتبط خلايا CAR-T بها وتنشط ، ثم تتكاثر وتصبح سامة للخلايا. تدمر خلايا CAR-T الخلايا من خلال عدة آليات ، بما في ذلك تكاثر الخلايا على نطاق واسع ، مما يزيد من درجة تسممها بالخلايا الحية الأخرى (السمية الخلوية) وعن طريق التسبب في زيادة إفراز العوامل التي يمكن أن تؤثر على الخلايا الأخرى مثل السيتوكينات والإنترلوكينات و عوامل النمو.
إنتاج خلايا CAR-T

تتمثل الخطوة الأولى في إنتاج خلايا CAR-T في عزل الخلايا التائية عن دم الإنسان. يمكن تصنيع خلايا CAR-T إما من دم المريض ، المعروف باسم العلاج الذاتي ، أو من دم متبرع سليم ، والمعروف باسم العلاج الخيفي. عملية التصنيع هي نفسها في كلتا الحالتين ؛ فقط اختيار المتبرع الأولي بالدم يختلف.
أولاً ، يتم عزل الكريات البيض باستخدام فاصل خلايا الدم في عملية تُعرف باسم فصادة خلايا الدم البيضاء. ثم يتم فصل خلايا الدم وحيدة النواة (PBMC) وجمعها. ثم يتم نقل منتجات فصادة كريات الدم البيضاء إلى مركز معالجة الخلايا. في مركز معالجة الخلايا ، يتم تحفيز الخلايا التائية المحددة بحيث تتكاثر بنشاط وتتوسع إلى أعداد كبيرة. لدفع توسعها ، يتم علاج الخلايا التائية عادةً باستخدام السيتوكين إنترلوكين 2 (IL-2) والأجسام المضادة لـ CD3.
يتم تنقية الخلايا التائية الموسعة ثم نقلها بجين يشفر CAR المهندسة عبر ناقل فيروسات قهقرية ، عادةً إما فيروسات قهقرية متكاملة (RV) أو ناقل بطني (LV). هذه النواقل آمنة جدًا في العصر الحديث بسبب الحذف الجزئي لمنطقة U3. تم استخدام أداة تحرير الجينات الجديدة CRISPR / Cas9 مؤخرًا بدلاً من ناقلات الفيروسات القهقرية لدمج جين CAR في مواقع محددة في الجينوم.
يخضع المريض للعلاج الكيميائي للنضاد اللمفاوي قبل إدخال الخلايا التائية المصممة هندسيًا. يؤدي استنفاد عدد الكريات البيض المنتشرة في المريض إلى تنظيم عدد السيتوكينات التي يتم إنتاجها ويقلل من التنافس على الموارد ، مما يساعد على تعزيز توسع خلايا CAR-T المهندسة.
التطبيقات السريرية
اعتبارًا من مارس 2019 ، كان هناك حوالي 364 تجربة سريرية جارية تحدث على مستوى العالم تشمل خلايا CAR-T. تستهدف غالبية هذه التجارب سرطانات الدم: تمثل علاجات CAR-T أكثر من نصف جميع تجارب الأورام الدموية الخبيثة. لا يزال CD19 هو الهدف الأكثر شيوعًا للمستضد ، يليه BCMA (يتم التعبير عنه بشكل شائع في المايلوما المتعددة). في عام 2016 ، بدأت الدراسات في استكشاف جدوى مستضدات أخرى ، مثل CD20. التجارب الخاصة بالأورام الصلبة أقل سيطرة من قبل CAR-T ، مع حوالي نصف التجارب القائمة على العلاج الخلوي التي تشمل منصات أخرى مثل الخلايا القاتلة الطبيعية.
سرطان
تم تصميم الخلايا التائية وراثيًا للتعبير عن مستقبلات المستضدات الكيميرية الموجهة تحديدًا نحو المستضدات الموجودة على الخلايا السرطانية للمريض ، ثم يتم ضخها في المريض حيث تهاجم الخلايا السرطانية وتقتلها. يعتبر النقل التبني للخلايا التائية التي تعبر عن CARs علاجًا واعدًا مضادًا للسرطان ، لأنه يمكن هندسة الخلايا التائية المعدلة بواسطة CAR لاستهداف أي مستضد مرتبط بالورم تقريبًا.
ركزت أبحاث الخلايا التائية CAR-T المبكرة على سرطانات الدم. تستخدم العلاجات الأولى المعتمدة CARs التي تستهدف المستضد CD19 الموجود في السرطانات المشتقة من الخلايا B مثل سرطان الدم الليمفاوي الحاد (ALL) وسرطان الغدد الليمفاوية B-cell الكبيرة المنتشر (DLBCL). هناك أيضًا جهود جارية لهندسة CAR التي تستهدف العديد من مستضدات سرطان الدم الأخرى ، بما في ذلك CD30 في ليمفوما هودجكين الحرارية ؛ CD33 و CD123 و FLT3 في ابيضاض الدم النخاعي الحاد (AML) ؛ و BCMA في المايلوما المتعددة.
تمثل الأورام الصلبة هدفًا أكثر صعوبة. كان تحديد المستضدات الجيدة أمرًا صعبًا: يجب التعبير عن هذه المستضدات بشكل كبير في غالبية الخلايا السرطانية ، ولكنها غائبة إلى حد كبير في الأنسجة الطبيعية. كما لا يتم نقل خلايا CAR-T بكفاءة إلى مركز كتل الورم الصلبة ، كما أن البيئة المكروية للورم المعادي تثبط نشاط الخلايا التائية.
مرض يصيب جهاز المناعه
بينما تركز معظم دراسات الخلايا التائية CAR T-cell على إنشاء خلية CAR T يمكنها القضاء على مجموعة معينة من الخلايا (على سبيل المثال ، خلايا CAR T التي تستهدف خلايا سرطان الغدد الليمفاوية) ، هناك استخدامات محتملة أخرى لهذه التقنية. يمكن للخلايا التائية أيضًا حماية المستضدات الذاتية من تفاعلات المناعة الذاتية. يمكن أن يكون للخلية التائية التنظيمية المجهزة بـ CAR لديها القدرة على منح التسامح لمستضد معين ، وهو شيء يمكن استخدامه في زراعة الأعضاء أو الأمراض الروماتيزمية مثل الذئبة.
ساتفي
هناك آثار جانبية خطيرة ناتجة عن إدخال خلايا CAR-T إلى الجسم ، بما في ذلك متلازمة إطلاق السيتوكين والسمية العصبية. نظرًا لأنه علاج جديد نسبيًا ، هناك القليل من البيانات حول التأثيرات طويلة المدى للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية. لا تزال هناك مخاوف بشأن بقاء المريض على المدى الطويل ، فضلاً عن مضاعفات الحمل لدى المريضات اللاتي عولجن بخلايا CAR-T. الحساسية المفرطة هي أحد الآثار الجانبية المتوقعة ، حيث يتم تصنيع CAR من جسم مضاد أحادي النسيلة أجنبي ، ونتيجة لذلك ، تثير استجابة مناعية.
يحدث التعرف على الهدف / خارج الورم عندما تتعرف خلية CAR-T على المستضد الصحيح ، ولكن يتم التعبير عن المستضد في نسيج صحي غير مُمْرِض. ينتج عن هذا أن خلايا CAR-T تهاجم الأنسجة غير الورمية ، مثل الخلايا البائية السليمة التي تعبر عن CD19. يمكن أن تختلف شدة هذا التأثير الضار من عدم تنسج الخلايا البائية ، والذي يمكن معالجته من خلال الحقن الداعمة ، إلى السمية الشديدة التي تؤدي إلى الوفاة.
هناك أيضًا احتمال غير محتمل أن تتحول خلايا CAR-T المصممة هندسيًا إلى خلايا سرطانية من خلال الطفرات الإدراجية ، بسبب الناقل الفيروسي الذي يُدخل الجين CAR في مثبط الورم أو الجين الورمي في جينوم الخلية التائية المضيفة. تحمل بعض ناقلات الفيروسات القهقرية مخاطر أقل من نواقل الفيروسة البطيئة (LV). ومع ذلك ، فإن كلاهما لديه القدرة على أن يكون الورم. تم إنشاء تحليل التسلسل الجيني لمواقع إدخال CAR في الخلايا التائية من أجل فهم أفضل لوظيفة الخلايا التائية CAR T والمثابرة في الجسم الحي.
متلازمة إطلاق السيتوكين
المشكلة الأكثر شيوعًا بعد العلاج بخلايا CAR-T هي متلازمة إطلاق السيتوكين (CRS) ، وهي حالة يتم فيها تنشيط الجهاز المناعي ويطلق عددًا متزايدًا من السيتوكينات الالتهابية. المظاهر السريرية لهذه المتلازمة تشبه تعفن الدم مع ارتفاع في درجة الحرارة ، والتعب ، وآلام عضلية ، والغثيان ، والتسربات الشعرية ، وعدم انتظام دقات القلب وغيرها من الخلل الوظيفي القلبي ، والفشل الكبدي ، وضعف الكلى. يحدث CRS في جميع المرضى تقريبًا الذين عولجوا بعلاج الخلايا التائية ذات مستقبلات المستضدات الوهمية في الواقع ، فإن وجود CRS هو علامة تشخيصية تشير إلى أن خلايا CAR-T تعمل على النحو المقصود لقتل الخلايا السرطانية. لاحظ ، مع ذلك ، أن الدرجة الأعلى من شدة CRS لا ترتبط بزيادة الاستجابة للعلاج ، بل ترتبط بعبء مرض أعلى.
السمية العصبية المرتبطة بخلايا المستجيب المناعي
غالبًا ما ترتبط السمية العصبية أيضًا بعلاج الخلايا التائية ذات مستقبلات المستضدات الوهمية. الآلية الأساسية غير مفهومة بشكل جيد ، وقد تكون أو لا تكون مرتبطة بـ CRS. تشمل المظاهر السريرية الهذيان ، والفقدان الجزئي للقدرة على التحدث بشكل متماسك بينما لا يزال لديك القدرة على تفسير اللغة (الحبسة التعبيرية) ، وانخفاض اليقظة (الحشو) ، والنوبات المرضية. خلال بعض التجارب السريرية حدثت حالات وفاة ناجمة عن السمية العصبية. السبب الرئيسي للوفاة من السمية العصبية هو وذمة دماغية. في دراسة أجرتها شركة Juno Therapeutics ، Inc. ، توفي خمسة مرضى مسجلين في التجربة نتيجة للوذمة الدماغية. عولج اثنان من المرضى بسيكلوفوسفاميد وحده بينما عولج الثلاثة الباقون بمزيج من سيكلوفوسفاميد وفلودارابين. في تجربة إكلينيكية أخرى برعاية مركز فريد هاتشينسون لأبحاث السرطان ، تم الإبلاغ عن حالة سمية عصبية قاتلة لا رجعة فيها بعد 122 يومًا من إعطاء خلايا CAR-T.
.












Discussion about this post